Materiales y Métodos
Las presentes recomendaciones fueron desarrolladas por
bioquímicos pertenecientes al Foro Argentino de Proteínas. Los autores se
reunieron mensualmente, de forma plenaria, durante el año 2019 en la Asociación
Bioquímica Argentina, mientras que, durante los años 2020, 2021 y 2022, las reuniones
se realizaron de forma virtual.
La metodología utilizada para la elaboración de estas Primeras
recomendaciones del laboratorio clínico en el estudio de las proteínas
séricas a partir del proteinograma electroforético consistió en la búsqueda
bibliográfica de trabajos de diferentes lugares relacionados con las etapas
preanalítica, analítica y posanalítica para la realización del proteinograma.
Se revisaron consensos escritos por otros países como Nueva Zelanda, Canadá y
España.2,3,5
La difusión de este documento tiene por objeto divulgar los
aspectos metodológicos y de formato de informe recomendados para la electroforesis de proteínas, con la finalidad de
que puedan ser utilizados por todos los laboratorios del país en pos de la
armonización.
1. Aspectos preanalíticos para la realización de proteinogramas
1.1. Tipo de muestra
La muestra de elección para el estudio
electroforético de las proteínas es el suero fresco. Esta debe ser obtenida por
venopunción y colocada en el interior del tubo, sin anticoagulante, hasta que
se produzca la coagulación completa. En caso de realizar una centrifugación
previa sin que se haya completado la formación del coágulo, puede observarse la
deformación de la fracción β-2 o la presencia de una banda homogénea en gamma
rápida por la presencia de fibrinógeno.5
1.2. Ayuno
Se recomienda que la extracción de la muestra se
realice con un ayuno previo de 8 horas, para evitar la interferencia por
hiperlipemia (“Apartado 1.4.1.”), principalmente cuando se utiliza como soporte
gel de agarosa.
1.3. Estabilidad y temperatura de conservación de la
muestra
Es recomendable la separación del suero del
paquete globular después de la centrifugación, lo antes posible. La estabilidad
a temperatura ambiente (20 - 25 °C) es de un día. Se puede conservar la muestra
hasta 7 días a 4-8 º C o hasta 3 semanas a -20 ºC.5
En caso de necesitar conservar la muestra
congelada para posterior análisis, se recomienda realizar alícuotas y que la
misma no sufra más de un proceso de congelación/descongelación, ya que puede
presentar una degradación in vitro de las proteínas del complemento y,
en consecuencia, una disminución de la fracción β-2-globulinas.
Se recomienda que el procesamiento se realice cuando la muestra se
encuentre entre 18 y 24ºC.
1.4. Interferencias
1.4.1. Lipemia
Las lipoproteínas migran en diferentes posiciones,
dependiendo de la técnica electroforética que se utilice: en soporte sólido,
suelen migrar en la zona de las alfa y beta globulinas, aunque, en
electroforesis capilar, suele verse un incremento de la zona posalbúmina. El
aumento de la concentración hallada en los sueros hiperlipémicos puede
dificultar la interpretación cuando se observa una zona beta aumentada o hasta
hacer sospechar de un componente monoclonal cuando se utiliza soporte sólido.
Se sugiere no trabajar con sueros hiperlipémicos.
En caso de no poder solicitar nueva muestra o esperar a que el paciente
resuelva la hiperlipemia, siempre aclarar que se trabajó con un suero lipémico.5
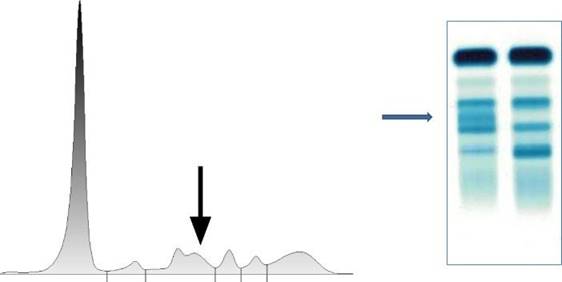
1.4.2. Hemólisis
Los complejos haptoglobina - hemoglobina formados durante la
hemólisis in vitro pueden originar un desdoblamiento o ensanchamiento de
la fracción α-2. La presencia de hemoglobina libre en el suero también puede
provocar estas mismas alteraciones en la fracción β-1. Por este motivo, se
recomienda trabajar con sueros sin hemólisis. En caso de no poder solicitar
nueva muestra, siempre aclarar que se trabajó con un suero con presencia de
hemólisis (Figura 1 y 2)5.
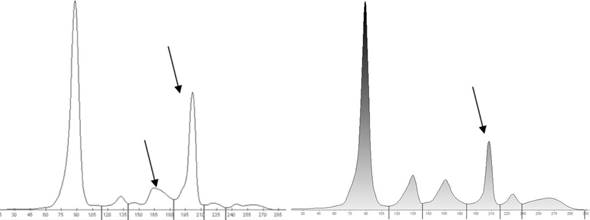
1.4.3. Fibrinógeno
La administración de medicamentos anticoagulantes
puede motivar la presencia de fibrinógeno en el suero. No se deben procesar
muestras que hayan sido extraídas en tubos con algún tipo de anticoagulante. En
el caso de poder confirmar la presencia de fibrinógeno, se debe aclarar la
presencia del mismo y sugerir repetición del estudio con una nueva muestra de
suero (Figura 3).5,6
1.4.4. Compuestos radiopacos y medicamentos
La administración intravenosa de contrastes químicos
utilizados en diferentes técnicas de imágenes puede ocasionar la aparición de
una banda adicional en las fracciones α-2 o β-globulinas emulando componentes
monoclonales, si la corrida se realiza en equipos de electroforesis capilar que
detectan proteínas con lecturas a 200 nm. Algunos antibióticos también pueden
originar este tipo de interferencias. Estas sustancias no afectan en corridas
en soportes sólidos, donde el método de detección es mediante la utilización de
colorantes. De sospechar o confirmar la presencia de un interferente de este
tipo, se debe incluir una leyenda y solicitar nueva muestra de suero teniendo
en cuenta la vida media de los componentes en cuestión.6,7
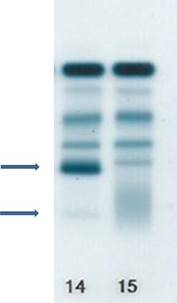
1.4.5. Anticuerpos monoclonales de terapéutica (daratumumab, elotuzumab,
etc.)
El tratamiento con anticuerpos monoclonales puede
ser el origen de una interferencia en la fracción gamma-globulinas, dependiendo
de la dosis y el régimen de administración. Todos los laboratorios deben
conocer a sus pacientes tratados con este tipo de terapia para evitar malas
interpretaciones de los análisis a realizar.5De tener conocimiento
de la presencia de alguno de estos componentes terapéuticos, es necesario poner
una leyenda que advierta de su presencia en el perfil del proteinograma
electroforético (Figura 4).
1.4.6. Crioglobulinas
Si se ha llevado a cabo en frío, en la
electroforesis de proteínas en soporte sólido, puede observarse acumulación en
el sitio de aplicación, que recrea la presencia de un “pico monoclonal”. En la
situación de tener un diagnóstico de crioglobulinas positivas, dichas muestras
deben sembrarse a 37°C al momento de procesarlas.
2. Aspectos sobre la metodología para realizar el proteinograma
electroforético
2.1. Tipos de soportes
Los dos tipos de electroforesis utilizados para
la separación de las proteínas plasmáticas presentes en el suero son:
electroforesis en soporte sólido y electroforesis capilar.
2.1.1. Electroforesis en soporte sólido
La capacidad de resolución y la sensibilidad
analítica de esta metodología dependen del soporte y colorante utilizados8.
En la práctica clínica, se utilizan habitualmente dos tipos de soporte: acetato
de celulosa y gel de agarosa.
El acetato de celulosa está siendo paulatinamente
reemplazado por métodos con mayor resolución como los geles de agarosa y la
capilaridad; estos dos últimos métodos son los recomendados por el Grupo
Internacional de Trabajo en Mieloma Múltiple (IMWG) para el estudio de gammapatías
monoclonales.
Cualquiera sea el colorante utilizado, deben
tenerse en cuenta dos posibles fuentes de error: la heterogénea captación de
colorante por unidad de masa entre las distintas fracciones proteicas y la
pérdida de linealidad de la fijación del colorante en relación con la
concentración de la proteína.
2.1.2. Electroforesis capilar
Todas las proteínas migran a distinta velocidad,
en función de su relación carga/masa, hacia un detector que mide la absorbancia
del enlace peptídico a 200 o 214 nm; esta absorbancia es proporcional al número
de uniones peptídicas. La lectura directa de las fracciones proteicas evita el
error por saturación de
unión al colorante
observado en las técnicas sobre soporte sólido, especialmente para componentes monoclonales
(CM) de altas concentraciones.
2.2. Requisitos analíticos del proteinograma electroforético
La separación electroforética de las proteínas
plasmáticas presentes en el suero se considera adecuada para los fines
diagnósticos, cuando se cumplen requisitos mínimos de calidad resolutiva en el
perfil proteico obtenido9. Estos incluyen:
●
visualización de banda tenue de prealbúmina
●
detección de heterocigosis de alfa-1-antitripsina
●
desdoblamiento de la zona de beta globulinas en beta-1 y beta-2
●
detección de CM de concentración igual o menor que 1 g/L (0,1
g/dl)
●
identificación de perfil oligoclonal en la zona gamma
2.3. Precisión de medida
Teniendo en cuenta la variabilidad biológica, se
han establecido especificaciones de calidad analítica para la imprecisión para
las distintas fracciones del proteinograma. Los valores de imprecisión
deseables, expresados como coeficientes de variación para las distintas
fracciones, son de 1,6 % para la albúmina; 5,7 % para alfa-1-globulinas; 5,2 %
para alfa-2-globulinas; 5,1 % para beta globulinas y 7,3 % para
gammaglobulinas.
Debido a la complejidad para cumplir las
especificaciones deseables en la fracción albúmina, se puede optar por cumplir
el requisito de mínima de 2,3 %.
La imprecisión interensayo descripta para los equipos
de electroforesis capilar actuales es menor que 2 % para la albúmina y que 7,7
% para el resto de las fracciones. En la electroforesis en gel de agarosa, la
imprecisión varía desde el 2,7 % al 8,0 %.9
Debido a que las fracciones del proteinograma
deben expresarse como concentraciones de masa (g/L o g/dL), es necesario
conocer la concentración de proteínas totales. Por lo tanto, la incertidumbre
de medida de la concentración de proteínas totales se suma a la asociada a la
electroforesis.10
Respecto de la cuantificación del CM, a la
incertidumbre de su medida contribuyen: la imprecisión de medida de la fracción
proteica, la imprecisión del valor de proteínas totales y la imprecisión
asociada al acotamiento del CM en el perfil electroforético. En el caso de CM
de baja concentración, la delimitación de los puntos de corte es un factor
importante de error.
Según datos bibliográficos, la imprecisión oscila
entre 11 - 29 % en geles de agarosa y entre 10 - 16 % en electroforesis capilar
para CM mayores que 0,1 g/dL (1g/L)10. Para minimizar el error
debido al acotamiento del CM, es aconsejable realizar el seguimiento siempre de
la misma forma.
2.4. Valores de referencia
Los valores de referencia de la separación de
proteínas en fracciones proteicas varían de acuerdo con la metodología
utilizada y la población en estudio. El laboratorio debe disponer y dejar
asentados en el informe los valores de referencia específicos discriminando por
rango etario.
Si comparamos los rangos de referencia para los
dos tipos de métodos electroforéticos mencionados, vemos que existe una buena
correlación entre las fracciones, pero se presentan diferencias significativas
en la fracción alfa-1-globulinas y, en menor medida, en la fracción albúmina9,10,11.
Estas diferencias se deben al principio de medida de las proteínas (unión a
colorantes o absorbancia a 214 nm).
Para la zona alfa-1-globulinas, la electroforesis
capilar presenta valores superiores a los obtenidos por electroforesis sobre
soporte sólido. Esto se debe a que la alfa-1-antitripsina es prácticamente la
única proteína de la fracción que se une al colorante, ya que la
alfa-1-glicoproteína presenta un alto contenido de ácido siálico, que disminuye
la afinidad por los colorantes. En el caso de la albúmina, debido a que esta
proteína presenta una alta afinidad por el colorante, los resultados obtenidos
en gel de agarosa son aproximadamente un 10 % superiores a los obtenidos por
capilaridad.
3. Aspectos sobre el informe del proteinograma sérico
Se
recomienda el siguiente contenido:
·
Identificación de la prueba en el informe clínico:
Título: Proteinograma sérico
Método: Electroforesis en acetato de celulosa/electroforesis
en gel de agarosa/electroforesis capilar
·
Número de fracciones: Se informarán las fracciones de acuerdo con
el sistema empleado:
-Cinco fracciones:
Alb/α1/α2/β/ϒ
-Seis fracciones:
Alb/α1/α2/β1/β2/ϒ
·
Unidades: Las fracciones proteicas deben informarse en unidades de
concentración. Estas unidades deben ser las mismas que las del dosaje de proteína
total. Pueden expresarse en g/L o g/dL. Opcionalmente, puede acompañarse este
resultado de los valores porcentuales de cada una de las fracciones.
·
Valores de referencia (VR): Deben constar en el informe los
VR correspondientes al grupo etario del paciente tanto de los porcentuales como
del valor absoluto. Las fuentes de los VR pueden provenir de estimaciones del
propio laboratorio, búsqueda bibliográfica (verificada en el laboratorio) o de la
otorgada por el fabricante (verificada en el laboratorio).
·
Curva densitométrica: Es opcional. No se considera indispensable a
los efectos interpretativos, si se respetan los contenidos recomendados.
·
Informe interpretativo: Debe proveer información sobre hallazgos
relevantes en el proteinograma y sugerir otros estudios, en caso de que se requieran.
En caso de que ninguna fracción proteica
se encuentre alterada, es opcional el comentario global. Se puede informar: perfil
sin particularidades. En cambio, si alguna de las fracciones se encuentra
alterada, se recomienda realizar un comentario descriptivo adjunto al
proteinograma.
Ejemplos:
-
Hipoalbuminemia
-
α1 marcadamente disminuida
-
Hipergammaglobulinemia policlonal
-
β2 marcadamente disminuida
-
Hipogammaglobulinemia
-
Fracciones α1 y α2 aumentadas
En caso de observarse una banda en zona de gammaglobulinas,
se sugiere utilizar el término banda homogénea (BH) y se debe describir
la movilidad, es decir, si la banda corre en zona rápida, media o lenta de
gammaglobulinas. También debe cuantificarse la banda homogénea en estudio;
utilizarse las mismas unidades que para las distintas
fracciones proteicas; aclarar por qué método se realizó la cuantificación
(tangencial/a línea de base) y sugerir estudios complementarios necesarios.
Cabe aclarar que la cuantificación de la banda homogénea debe realizarse
siempre por el mismo método.
Se desaconseja fuertemente utilizar terminología ambigua para
describir la banda anómala, tal como restricción electroforética, condensación,
distorsión, componente M, proteína M, banda monoclonal.
A continuación, presentamos un ejemplo de informe adecuado:
Se observa banda homogénea en zona (rápida/media/lenta) de ϒ
globulinas. Medida de la banda por (método tangencial/ a línea de base): xx,x
g/dl (g/l). Se sugiere completar su estudio por inmunofijación sérica,
cuantificación de inmunoglobulinas totales y de cadenas livianas libres (CLL)
en suero; así como también estudios en orina de 24 horas (electroforesis e inmunofijación).
4. Aspectos sobre oligoclonalidad
Las disgammaglobulinemias oligoclonales pueden confundirse
con las gammapatías monoclonales.12
La presencia de esta patente suele estar relacionada con
complejos inmunes circulantes contra antígenos extraños, ambientales o
autoantígenos. La oligoclonalidad se observa principalmente en infecciones
crónicas, enfermedades autoinmunes, enfermedades por inmunocomplejos, hepatitis
crónicas, algunos estadios de pacientes VIH positivos, en trasplantes o en
tratamiento con quimioterapia de inducción en pacientes con mieloma múltiple
(Tabla I).12,13
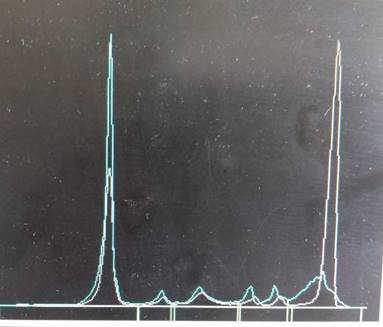
La oligoclonalidad es una patente proteica que, en el
proteinograma, tiene dos formas de presentación: como varias bandas o como una
zona de mayor condensación en la región de gammaglobulinas.
La importancia de diferenciar la patente oligoclonal de la
monoclonal radica en el hecho de que una confusión entre ambas se traduce en
tratamientos completamente distintos. Por ello, es sumamente importante tener
conocimiento de la presentación clínica, del diagnóstico presuntivo y de otros
parámetros bioquímicos del paciente en estudio.14
Frente a la sospecha de una patente oligoclonal en el
proteinograma electroforético, se podría completar el estudio cuantificando las
inmunoglobulinas (por turbidimetría y/o nefelometría), realizar inmunofijación
para descartar monoclonalidad (en el caso en que la imagen presente dudas) y,
además, observar si hay presencia de crioglobulinas en el suero. En la
inmunofijación sérica, se verá reacción con uno o varios de los antisueros
anticadenas pesadas y livianas. También es aconsejable tener una alícuota del
suero congelada para evaluar y comparar posteriores corridas electroforéticas y
observar presencia o ausencia de alguna de las bandas.
Adicionalmente, se recomienda sugerir el estudio por
inmunofijación y el control periódico para observar la evolución de la respuesta
inmune expresada por la patente oligoclonal.
El control periódico de los pacientes que presentan una
disgammaglobulinemia debe realizarse con las mismas metodologías para que los
resultados sean comparables.12-14
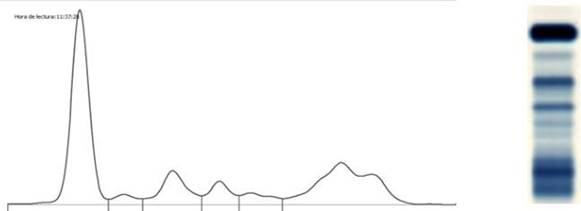
4a) Informe de la oligoclonalidad en el proteinograma
Se
sugiere informar de la siguiente manera: Se observa región de
gammaglobulinas con características oligoclonales. Se sugiere control periódico.
(Figura 5)
4 b) Informe de la oligoclonalidad en la inmunofijación
Se
sugiere informar: Inmunofijación compatible con características
oligoclonales y de forma opcional, describir calle por calle y luego,
escribir un comentario final. (Figura 6)
4c) Oligoclonalidad post - trasplante autólogo de médula ósea
(TAMO) en pacientes con mieloma múltiple (MM).
La presencia de bandas oligoclonales (BO) dificulta el
monitoreo de la concentración del componente monoclonal (CM) del paciente con
MM sometido a TAMO. Suele observarse en la evolución que, frente a la
desaparición de las BO, los pacientes recuperan los
niveles de inmunoglobulinas policlonales, con ausencia del componente
monoclonal original confirmada por inmunofijación.15
También es importante remarcar si se observa el componente
monoclonal original o no, ya que ayuda en el seguimiento del paciente.
En la electroforesis, el registro de la localización del
componente homogéneo original resulta fundamental, ya que facilita el
reconocimiento de bandas oligoclonales en el postrasplante de médula ósea. El
hecho de reconocer que la ubicación de la nueva banda es diferente de la banda
monoclonal original, a pesar de que la banda oligoclonal sea del mismo isotipo que
el componente monoclonal original, permite determinar que representa una
inmunoglobulina benigna y regenerativa en lugar de una recurrencia o
persistencia de un clon maligno (Figura 7).16
Además, se ha visto que en los pacientes que presentaron
bandas oligoclonales en su evolución, el tiempo de supervivencia global
observado fue significativamente más prolongado, por lo que se lo ha
considerado un marcador pronóstico favorable. De
allí, la importancia de su descripción en el proteinograma y la necesidad de
comunicarlo en el informe.17
Por otro lado, en presencia de valores aumentados
de la zona de γ-globulina del proteinograma electroforético con BO, puede ser
observada una relación de cadenas livianas libres anormal, lo que dificulta la
valoración de una respuesta completa estricta. Es por ello que su seguimiento
cercano es esencial debido a la dificultad adicional en la interpretación de
los estudios proteicos, cuando se evalúa la respuesta terapéutica y la
evolución.18
5. Aspectos sobre el análisis del componente monoclonal
5.1. Cuantificación del CM2,19-22
Ante la presencia de una banda homogénea en el
proteinograma, se debe registrar su movilidad y cuantificarla por medida
directa del perfil electroforético (densitometría para electroforesis sobre
soporte sólido o espectrofotometría para electroforesis capilar).
Desde hace décadas, y hasta el día de la fecha,
se usa la demarcación perpendicular de pico a línea de base, a pesar de ser un
método subjetivo, dependiente del operador y sujeto a la sobreestimación por
las inmunoglobulinas presentes en el fondo policlonal.
La cuantificación del pico monoclonal presenta
diversas fuentes de error, que deben ser tenidas en cuenta y que varían de
acuerdo con la técnica utilizada y su movilidad electroforética. Se presentan
dificultades en la medida del CM en:
- zona gamma sobre fondo policlonal
- zona no gamma
- presencia de CM polimerizados
- CM con patrón de migración ancho
- subestimación del CM por saturación del
colorante para electroforesis en soporte sólido
Las diferentes estrategias para optimizar la
medida del CM van desde modificar la delimitación del pico hasta incluir otras
metodologías que permitan la exclusión de las inmunoglobulinas policlonales y
de otras proteínas normales presentes en esa fracción, a saber:
-
Medida inmunoquímica de la inmunoglobulina involucrada por inmunonefelometría
o inmunoturbidimetría, información que reemplaza o complementa la medida del
CM.
-
Uso del método tangencial para delimitar el CM, que excluye el
fondo policlonal. Hasta ahora, esta opción se usa solo para zona gamma.
-
En el caso de trabajar con electroforesis capilar, se puede
recurrir a la inmunosustracción para seleccionar una zona de interés en la
región beta de modo que se excluyan así otras proteínas presentes en esa
fracción.
En todos los casos, se hace imprescindible
aclarar la metodología utilizada para demarcar el pico de proteína monoclonal y
se debe recomendar hacer seguimiento con el mismo método.
5.1.1. Cuantificación de CM en zona no gamma2,19 -22
5.1.1.1 Limitaciones para la cuantificación de pico
En diferentes situaciones donde la cuantificación
del CM es compleja (por su baja concentración, por estar superpuesto con otras
proteínas o por no observarse una clara individualización dentro de un perfil oligoclonal),
cada laboratorio decide reportar el CM de forma cuali o cuantitativa. En caso
de no realizar la cuantificación,es recomendable aclarar la causa y,
eventualmente, sugerir estudios complementarios.
La cuantificación y seguimiento de un CM en zona
alfa, beta o beta - gamma, representan un desafío para el laboratorio de proteínas.
Frecuentemente, corresponden a CM de tipo IgA, aunque, ocasionalmente, otros
isotipos migran también en zona no gamma.
Mientras que la cuantificación del CM por delimitación de
pico sobreestima por la presencia de proteínas que migran conjuntamente en
dicha zona (ej. Transferrina, C3), la cuantificación por inmunoquímica mide el
total de inmunoglobulina (monoclonal + policlonal). Tanto la nefelometría como
la turbidimetría sobreestiman para todos los isotipos, pero presentan, en
general, buena concordancia para IgA. Para CM a IgG mayor que 3,0 g/dl, se
produce subestimación de pico por saturación de colorante. En el caso de IgM,
la discordancia es mayor: usualmente, IgM por inmunoquímica es 1,8 veces mayor
que el valor de pico. Por lo expuesto, los resultados por ambas metodologías no
son intercambiables y debe consignarse en el informe cuál se utilizó.
Teniendo en cuenta las limitaciones de cada
técnica, se proponen diferentes alternativas:
- Cuantificación inmunoquímica de la
inmunoglobulina comprometida.
En el año 2014, el IMWG recomienda el monitoreo
de CM IgA que migran en zona beta por medida de IgA total en vez de
delimitación de pico. El dosaje de Heavy Light Chain (HLC) es un método
que permite cuantificar por separado los diferentes tipos de cadenas ligeras de
cada clase de inmunoglobulina (por ejemplo, se mide el par IgA kappa e IgA
lambda para los frecuentes CM de tipo IgA en zona beta) y surge como una
alternativa al dosaje de IgA total.
- Separación electroforética por EC, seguida de inmunosustracción
(que identifica así proteínas que migran conjuntamente con el componente
monoclonal).
- Cuantificación inmunoquímica de la
inmunoglobulina comprometida, simultáneamente con densitometría de pico.
Varios factores dificultan dar recomendaciones
universales: ausencia de consenso en el ámbito internacional, diferente
disponibilidad de técnicas analíticas (CE, HLC, inmunosustracción) y un formato
establecido a lo largo del tiempo para comunicar resultados al médico hematólogo.
Sin embargo, la delimitación de pico junto con la determinación de la
inmunoglobulina comprometida parecería la mejor opción para el monitoreo de
pacientes con gammapatías monoclonales.
En el caso de que el laboratorio opte por
cuantificar pico en zona no gamma, debe tener presente lo siguiente:
- Cuando la fracción no gamma que contiene al CM
presenta un valor normal, no es posible su cuantificación y se debe recurrir al
método inmunoquímico. A continuación, presentamos un ejemplo de cómo podría
informarse adecuadamente: Se observa banda homogénea en zona beta-2 no
cuantificable por delimitación de pico.
- Cuando la fracción no gamma que contiene al CM
supera el valor de referencia, se recomienda informar como valor aproximado. Se
recurre habitualmente a dos tipos de aproximaciones: restar al CM el valor
promedio de la concentración de proteínas de la fracción donde se encuentra o
informar concentración total de alfa/beta + CM, por ejemplo, de la siguiente
manera: Se observa banda homogénea en zona beta-2 con una concentración
estimada de x g/dl (o g/L).
- Cuando el CM se presenta entre dos fracciones proteicas,
por ejemplo, entre alfa-1 y alfa-2, entre beta-1 y beta-2 o en beta-2-gamma,
también se reporta su cuantificación como valor aproximado, por estar
parcialmente solapado con una o más fracciones del perfil electroforético.
La elección de un método u otro dependerá de cada
laboratorio, pero es importante respetar el mismo criterio de cuantificación
para un correcto seguimiento a lo largo del tiempo. Conocer las limitaciones de
las técnicas utilizadas permite elegir la mejor estrategia de seguimiento.
5.2. Límite de cuantificación23-27
El límite de cuantificación del CM está en el
orden de 1 g/L (0,1 g/dL). Dependerá de la zona de migración, del isotipo de
inmunoglobulina, del fondo de inmunoglobulinas policlonales, del soporte e
instrumento utilizado, del conocimiento de datos previos del paciente y de la
experiencia del observador. Componentes que están por debajo de este valor no
pueden ser cuantificados de forma confiable, especialmente si hay un fondo
policlonal, y debería informarse cada uno como menor que 1 g/L (0,1 g/dL).
6. Aspectos sobre inmunofijación
6.1. Aspectos sobre inmunofijación sérica19,22,28-30
La observación de una banda homogénea (BH) en el
proteinograma electroforético (PES) requiere ser verificada. Es por ello por lo
que en el presente consenso se incluye una breve descripción de los dos métodos
necesarios para confirmar su presencia.
Para la caracterización de la BH, contamos con
dos técnicas: la inmunofijación sobre soporte sólido y la inmunosustracción o inmunotyping
en medio líquido.
La inmunofijación (IF) es una electroforesis de
zona seguida de una inmunoprecipitación con anticuerpos monoespecíficos para
cadenas pesadas (G, A, M) y cadenas livianas (κ y λ), con posterior coloración
del complejo Ag-Ac precipitado con negro amido o violeta ácido (este último es
más sensible). Las muestras se diluyen para enfrentarse con los antisueros
según las indicaciones del fabricante de los reactivos utilizados. De ser
posible, hay que realizar previamente el dosaje de las inmunoglobulinas por si
fuera necesario hacer una mayor dilución en alguna de las calles.
La IF es la técnica más utilizada en la
actualidad y la recomendada por el Grupo Internacional de Trabajo en Mieloma Múltiple
(IMWG, por sus siglas en inglés) para la tipificación del componente monoclonal
en el diagnóstico y seguimiento de las patologías linfoproliferativas.
La inmunosustracción consiste en la tipificación
del componente monoclonal por electroforesis capilar (EC) utilizando
anticuerpos monoespecíficos. Se realiza el PES del paciente y se observa su
perfil proteico. Seguidamente, se mezcla en un equipo automatizado la muestra
con cada uno de los anticuerpos contra cadenas pesadas (G, A, M,) y cadenas
livianas (κ y λ) y se procesa como 5 muestras independientes. Se superpone cada
perfil de las 5 mezclas con los antisueros con la curva del PES tomada como
patrón. Se observa la disminución o desaparición del pico monoclonal en el
perfil de la mezcla con algún antisuero y así se tipifica el CM.
6.2. Límite de detección
El límite de detección en inmunofijación varía de
0,12 a 0,25 g/L y para inmunosustracción, es de 0,25 g/L. Para ambas técnicas,
puede variar según la posición del pico y el fondo policlonal. Para la IF,
también depende del colorante utilizado.
6.3. Utilidad de la inmunofijación
La iInmunofijación es de utilidad ante:
- la presencia de una banda homogénea en el PES
- presencia de hipogammaglobulinemia sin causa
que la justifique
- sospecha de CM en las fracciones alfa 2 y beta
- cambio de movilidad del CM en el PES
- desaparición del CM en el PES
- y como criterio para evaluar remisión
completa.
6.4. Interpretación en informe
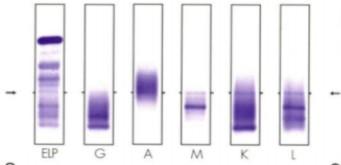
Se deben observar las seis calles de la IF: la primera
representa el PES y las siguientes, el enfrentamiento con los distintos
antisueros monoespecíficos.
-
La
precipitación difusa y tenue en todas las calles indica una muestra normal. Se
informa como patrón compatible con perfil policlonal (Figura 8).
-
La
presencia de precipitado en alguna de las calles, que involucra una cadena
pesada (G; A; M), y un precipitado de la misma movilidad en alguna de las
calles, que involucra las cadenas livianas (kappa o lambda), indican la
presencia de una banda monoclonal. Es importante remarcar que los dos
precipitados deben tener la misma movilidad que la BH observada en la primera
calle. Se debe informar tanto la cadena pesada como liviana involucradas
(Figura 9).
-
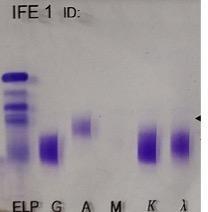
La
presencia de precipitado en alguna de las calles de cadenas livianas y no en cadenas pesadas puede deberse a una gammapatía IgD
o IgE y se debe confirmar utilizando antisueros anti - D y E para descartar la
presencia de estas cadenas pesadas; o puede deberse a la presencia de una
cadena ligera libre, que se deberá que confirmar con los antisueros específicos
anticadenas ligeras libres kappa o lambda (Figura 10).
-
Si se observan dos bandas en la zona correspondiente a las cadenas
pesadas (iguales o diferentes) y dos bandas correspondientes a las cadenas
livianas (iguales o diferentes), estamos en presencia de una biclonalidad,
siempre dentro de un contexto clínico que lo confirme (Figura 11).
-
Si se observan múltiples bandas en una o varias cadenas pesadas y
en una o en las dos cadenas ligeras, se está en presencia de un patrón
oligoclonal.
-
La presencia de varias bandas en una misma cadena pesada y una
misma cadena liviana podría deberse a inmunoglobulinas polimerizadas, las
cuales deberían tratarse con β-mercaptoetanol (u otro agente despolimerizante) y volver a realizar la IF.
Resumen
En el informe debe constar:
·
Presencia o ausencia de CM.
·
Si hay CM, la cadena pesada y liviana involucrada por ejemplo .:
IgGκ
·
Si solo hay precipitado de cadena liviana, se debe aclarar si se
enfrentó con antisueros para cadenas pesadas D y E.
Además, se deberían incluir recomendaciones acerca de la necesidad
de realizar estudios de mayor sensibilidad para la detección de cadenas
livianas como la inmunofijación en orina o dosaje de cadenas livianas libres en
suero en aquellos casos de componentes de muy baja concentración.
Interferencias y limitaciones
-
Crioglobulinas: puede aparecer una banda en todas las calles en el
punto de siembra.
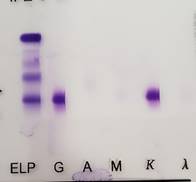
-
Fibrinógeno: aparece como una banda en la calle del PES que no
correlaciona con ninguna banda en el resto de las calles (Figura 3).
-
Con fondo policlonal marcado, se debe realizar una mayor dilución
de la muestra.
Referencias bibliográficas
1. Rajkumar S, Dimopoulos M, Palumbo
A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group
updated criteria for the diagnosis of multiple myeloma. Lancet Oncol.
2014;15(12): 538-4.
2. Tate J, Caldwell G,
Daly J, Gillis D, Jenkins M, Jovanovich S,et al. Working Party on Standardised
Reporting of Protein Electrophoresis. Recommendations for standardized
reporting of protein electrophoresis in Australia and New Zealand. Ann Clin
Biochem. 2012;49(Pt 3):242-56
3. Bootha R, McCudden C,
Balionb C, Blasutigc I,Byouhtiauyd I, Rodriguez-Capotee K, et al. Candidate
recommendations for protein electrophoresis reporting from the Canadian Society
of Clinical Chemists Monoclonal Gammopathy Working Group. Clin Biochem.
2018;51:10-20.
4. Acastello NE, Arco SE, Baquio MI,
Bovone NS, Crispiani IA; De Marco B, et al.
State of the
art in the protein study field. Results of the survey carried out by the
protein forum from October 2018 to March 2019 in Argentina. ByPC; sep-dic 2021;
85(3):26-31//ISSN-e 2684-0359
5. Pérez Surribas D, Cárdenas Fernández MC, Zapico Muñiz E. Recomendaciones
sobre la separación electroforética de las proteínas plasmáticas en el suero. Documentos de la SEQC
2015; 91-104.
6. World Health Organization. Diagnostic Imaging and Laboratory Technology.
(2002). Use of anticoagulants in diagnostic laboratory investigations. World
Health Organization. https://apps.who.int/iris/handle/10665/65957
7.
Carballo L, Carballeira L, Calvo M, Rentería YM, García-Moll X, Martínez-Bru C.
Interferencias por contrastes yodados en la electroforesis capilar. Rev Lab Clin.
2010;3:129-35.
8.
Aguzzi F, Allen W, Bienvenu J, Craig WY, Davis AE, Guder W. et al. Serum Proteins
in Clinical Medicine. Volume I. Laboratory Section. 1.ª ed. Scarborough: Robert
F. Ritchie, M.D.; 1996.
9. Doménech MV,
Hernández A, Ricós C, Minchinela J et al. Variación biológica en patologías:
revisión de datos y consecuencias clínicas. Rev Lab Clin 2008;1:17-23.
10. Gella
FJ, Canalías F, Izquierdo S, Martínez V, Sánchez. M. Recomendaciones para la
estimación de la incertidumbre de medida en el laboratorio clínico. Documentos de la SEQC. 2009;27-9.
11.
Luraschi P, Infusino I, Merlotti C, Franzini C. Analytical variation in the
measurement of serum monoclonal component by capillary electrophoresis. Clin Chim Acta.
2004;349(1-2):151-6.
12. Osatinsky R. Las proteínas Séricas.
1.ª ed. Ciudad Autónoma de Buenos Aires: Ed Emma Fiorentino Publicaciones
Técnicas S.R.L.; 2012. 97 p.
13.
Osatinsky R, Desimone IV, Garnek L. Incidencia de patente oligoclonal en
población adulta aparentemente sana. Rev Mex Patol Clin Med Lab.
2004;51(2):90-92.
14.
Osatinsky R, Desimone I, Garnek L. Importancia de la diferenciación de patentes
poli, oligo y monoclonales: su valor diagnóstico. Rev. Mexicana de Patología
Clínica. 2004;51:167-170.
15.
Alejandre M, Madalena L, Facio M, Bresciani P, Fraind S, Corrado C et al.
Bandas proteicas anómalas post-trasplante autólogo de médula ósea en pacientes
con mieloma múltiple. Bioquímica
y Patología Clínica 2000;64:25-31.
16.
Singh G, Vyas S. Prospective identification of oligoclonal/anormal band of the
same inmunoglobuline type as the malignant clone by differential location of
M-spike and oligoclonal band. J Clin Med Res.2017; 9(10):826-830.
17.
Alejandre ME, Madalena LB, Pavlovsky MA, Facio ML, Corrado C, Milone G et al. Oligoclonal bands and
immunoglobulin isotype switch during monitoring of patients with multiple
myeloma and autologous hematopoietic cell transplantation: a 16-year
experience. Clin Chem Lab Med. 2010;48(5):727-31.
18.
Alejandre ME, Pavlovsky MA, Remaggi G, Corrado C, Fernandez I, Milone G et al.
Serum free light chains and oligoclonal bands in patients with multiple myeloma
and autologous stem cell transplantation. Clin Chem Lab Med. 2012;50(6):1093-7.
19.
Willrich MA, Katzmann JA. Laboratory testing requirements for diagnosis and
follow-up of multiple myeloma and related plasma cell dyscrasias. Clin Chem Lab
Med. 2016;54(6):907-19.
20.
Dejoie T, Lakomy D, Caillon H, Pegourié B, Decaux O. Recommandations de l’IFM
(Intergroupe francophone du myélome) pour l’harmonisation de l’analyse des
électrophorèses des protéines sériques et urinaires dans le diagnostic et le
suivi du myélome multiple. Annales de Biologie Clinique. 2016;74(4):429-441.
21.
Keren DF, Schroeder L. Challenges of measuring monoclonal proteins in serum.
Clin Chem Lab Med. 2016;54(6):947-61.
22. A,
Lin DCC, McCurdy A, Rupani N, Kew A. Synoptic reporting for protein
electrophoresis and immunofixation. Clin Biochem. 2018;51:21-28.
23.
Poisson J, Fedoriw Y, Henderson M, Hainsworth S, Tucker K, Uddin Z, et al.
Performance evaluation of the Helena V8 capillary electrophoresis system. Clin
Biochem.2012;45:697-9.
24.
Katzmann JA, Clark R, Sanders E, Landers JP, Kyle RA. Prospective study of
serum protein capillary electrophoresis and immunotyping of monoclonal proteins
by immunosubtraction. Am J Clin Pathol.1998;110:503-9.
25.
Marien G, Vranken G, Demuylder M, Blanckaert N, Bossuyt X. Clinical capillary
zone electrophoresis of serum proteins: balancing high sensitivity and high
specificity. Clin Chem.2003;49:1419-20.
26.
Bergón E, Miranda I, Miravalles E. Linearity and detection limit in the measurement
of serum M-protein with the capillary zone electrophoresis system Capillarys.
Clin Chem Lab Med. 2005;43:721-3.
27.
Bienvenu J, Graziani MS, Arpin F, Bernon H, Blessum C, Marchetti C, et al.
Multicenter evaluation of the Paragon CZE 2000 capillary zone electrophoresis
system for serum protein electrophoresis and monoclonal component typing. Clin
Chem.1998;44:599-605.
28.
Dimopoulos M, Kyle R, Fermand JP, Rajkumar SV, San Miguel J, Chanan-Khan A, et
al. International Myeloma Workshop Consensus Panel 3. Consensus recommendations
for standard investigative workup: report of the International Myeloma Workshop
Consensus Panel 3. Blood. 2011;117(18):4701-5.
29.
McCudden CR, Mathews SP, Hainsworth SA, Chapman JF, Hammett-Stabler CA, Willis
MS, et al. Performance comparison of capillary and agarose gel electrophoresis
for the identification and characterization of monoclonal immunoglobulins. Am J
Clin Pathol. 2008;129(3):451-8.
30. Snyder J, Willis M,
Grenache D. Inmunofixation reveals and apparent alpha heavy chain caused by
precipitation of fibrinogen with IgA antiserum. Clin Chim Acta 368 (2006)
192-194.
31. Gertz MA, Rajkumar SV.
Multiple Myeloma Diagnosis and Treatment. 1.ª ed. New York: Springer; 2014.
32. Keren DF,
Bocsi G, Billman BL, Etzell J, Faix JD, Kumar S, Lipe B, McCudden C, Montgomery
R, Murray DL, Rai AJ, Redondo TC, Souter L, Ventura CB, Ansari MQ. Laboratory
Detection and Initial Diagnosis of Monoclonal Gammopathies. Arch Pathol Lab
Med. 2022 May 1;146(5):575-590. doi: 10.5858/arpa.2020-0794-CP. PMID: 34347866.
33.
Dispenzieri A, Kyle R, Merlini G, Miguel JS, Ludwig H, Hajek R, Palumbo A,
Jagannath S, Blade J, Lonial S, Dimopoulos M, Comenzo R, Einsele H, Barlogie B,
Anderson K, Gertz M, Harousseau JL, Attal M, Tosi P, Sonneveld P, Boccadoro M,
Morgan G, Richardson P, Sezer O, Mateos MV, Cavo M, Joshua D, Turesson I, Chen
W, Shimizu K, Powles R, Rajkumar SV, Durie BG; International Myeloma Working
Group. International Myeloma Working Group guidelines for serum-free light
chain analysis in multiple myeloma and related disorders. Leukemia. 2009
Feb;23(2):215-24. doi: 10.1038/leu.2008.307. Epub 2008 Nov 20. PMID: 19020545.
34.
Willrich MA, Katzmann JA. Laboratory testing requirements for diagnosis and
follow-up of multiple myeloma and related plasma cell dyscrasias. Clin Chem Lab
Med. 2016 Jun 1;54(6):907-19. doi: 10.1515/cclm-2015-0580. PMID: 26509779.
Tabla I. Casos asociados a oligoclonalidad.
|
Infecciones agudas
o crónicas recurrentes
|
|
Hepatitis
|
|
HIV-SIDA
|
|
Enfermedades por depósito de complejo inmune circulante
|
|
Enfermedades autoinmunes
|
|
Neoplasias
|
|
Síndrome de Guillain-Barré
|
|
Neuropatía periférica
|
|
Trasplantes
|